近日,化材学院邓卫平教授团队在手性叔醇的催化不对称合成领域取得突破性进展,相关研究成果以题为《Asymmetric Trapping of Siloxyketenes in situ Generated from [1,3]-Silyl Migration of α-Ketoacylsilanes: A Visible-Light-Driven Palladium-Catalyzed [4+2] Cycloaddition》的论文在国际权威期刊ACS Catalysis(2025年影响因子11.7)在线发表(DOI: 10.1021/acscatal.5c01239)。
手性叔醇因立体的位阻大且常含手性中心,在天然产物、药物分子(如抗生素和抗癌剂)中具有独特生物活性。然而,如何高效、高立体选择性地构建其核心骨架—α-手性叔醇羰基结构,一直是合成化学领域的重大挑战。
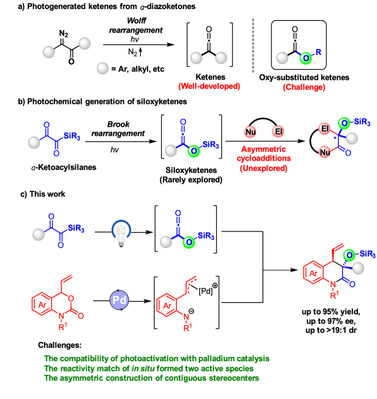
针对这一挑战,作者创新性地提出可见光诱导的Brook重排原位生成硅氧基烯酮中间体与偶极子进行催化不对称环加成方式来构建α-手性叔醇羰基结构的策略。基于该策略,作者首次实现硅氧基烯酮与1,4-偶极子的催化不对称[4+2]环加成反应,成功合成了一系列α-手性叔醇喹啉酮衍生物。该反应体系具有条件温和、底物适用范围广、收率高(最高达95%)、立体选择性优异(非对映选择性最高达>19:1,对映选择性最高达97%)等优势。此外,作者将该产物进行了深入的衍生化研究,展示了其在药物合成中潜在的应用价值。13C标记实验揭示了Brook重排的反应路径,证实了[1,3]-硅基迁移过程的存在;进一步的机理实验和DFT理论计算表明BOX配体的侧链效应和α-羰基酰基硅烷的硅基位阻在立体选择性控制中起到了关键作用。总之,该研究不仅首次实现硅氧基烯酮中间体与1,4-偶极子的催化不对称[4+2]偶极环加成,突破了不对称环加成领域的烯酮前体限制,还为手性药物优势结构α-手性叔醇羰基结构的催化不对称合成提供了一条高效、高立体选择性的途径,具有重要的科学意义和应用前景。
yl23455永利官网为该论文第一单位和通讯单位,化材学院邓卫平教授、郑汉良博士和汪全南博士为论文的共同通讯作者。此论文工作得到了国家自然科学基金、“手性催化合成”浙江领军型创新团队、浙江省自然科学基金和yl23455永利官网启动经费的经费支持。
编辑:张文潇


